- Giỏ hàng của bạn đang trống
- Tiếp tục mua hàng

Sản phẩm
Mô tả sản phẩm
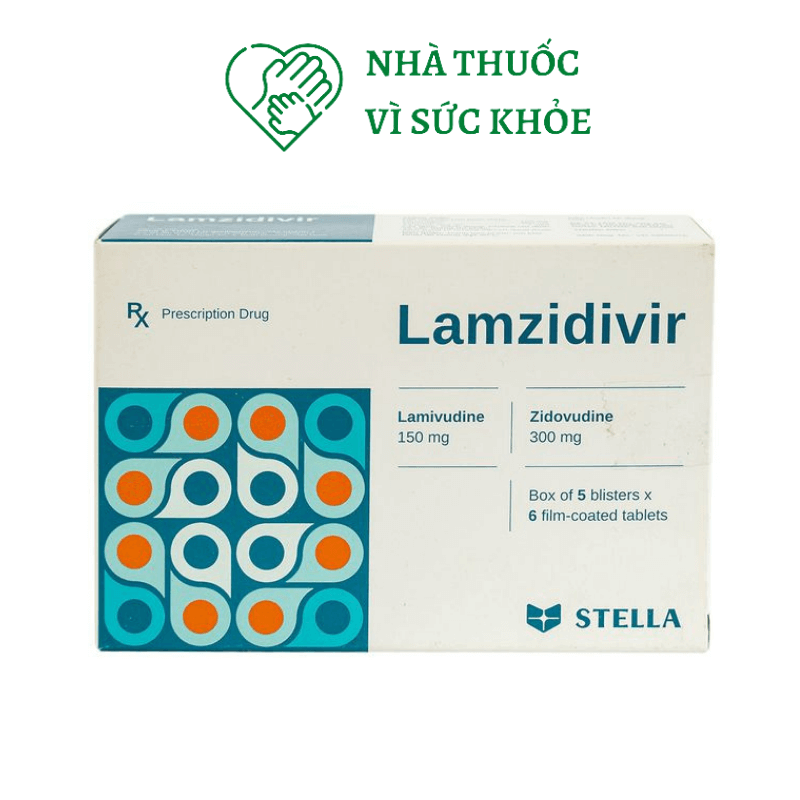
Lamzidivir 300 có thành phần chính lamivudine và zidovudine, là thuốc kháng virus tác động trực tiếp được sử dụng trong liệu pháp kết hợp các thuốc kháng retrovirus để điều trị nhiễm HIV.
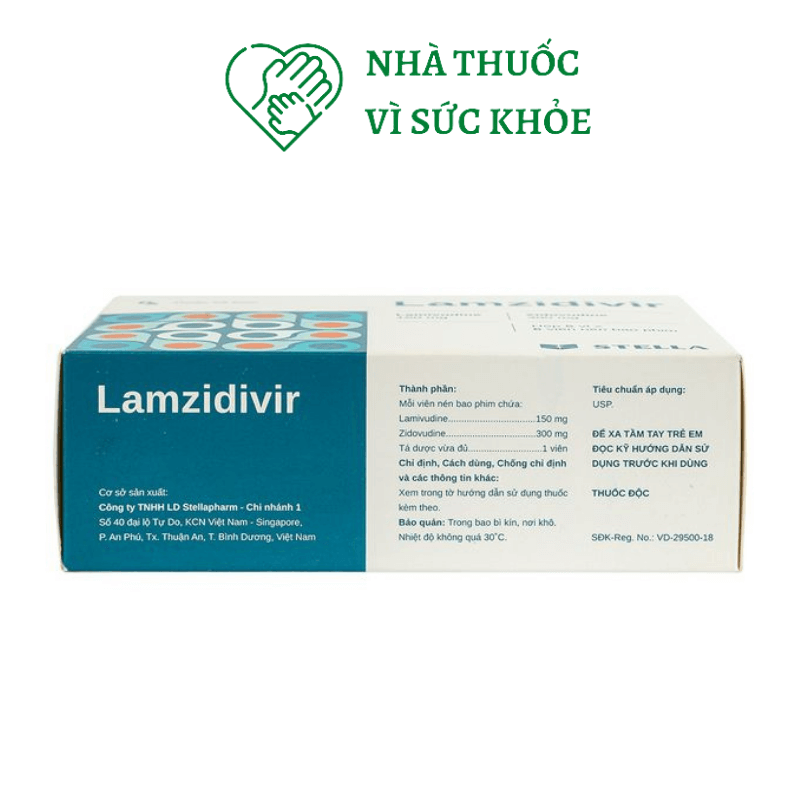
Lamzidivir 300 được sản xuất bởi Công ty TNHH LD Stellapharm – Việt Nam, lưu hành với số đăng ký VD-17209-12. Lamzidivir 300 được bào chế dưới dạng hộp 5 vỉ 6 viên nén bao phim, viên nén dài, bao phim màu trắng, hai mặt khum, một mặt có khắc vạch, một mặt khắc logo công ty, có thể bẻ đôi..
Công dụng của Lamzidivir 300
Dược lực học
Lamivudine là một chất tương tự nucleosid tổng hợp. Trong tế bào, lamivudine được phosphoryl hóa thành chất chuyển hóa 5′-triphosphat có hoạt tính, lamivudine triphosphat (3TC-TP).
Cơ chế tác động chính của 3TC-TP là ức chế men sao chép ngược (RT) của HIV-1 thông qua việc kết thúc chuỗi DNA sau sự hợp nhất của chất tương tự nucleosid. 3TC-TP là chất ức chế yếu polymerase DNA (alpha, beta, gamma) của tế bào.
Zidovudine là một chất tương tự nucleosid tổng hợp. Trong tế bào, zidovudine được phosphoryl hóa thành chất chuyển hóa 5′-triphosphat có hoạt tính, zidovudine triphosphat (ZDV-TP).
Cơ chế tác động chính của ZDV-TP là ức chế RT thông qua việc kết thúc chuỗi DNA sau khi sự hợp nhất của chất tương tự nucleosid. ZDV-TP là chất ức chế yếu polymerase DNA (alpha và gamma) của tế bào và được ghi nhận là có sát nhập vào DNA của các tế bào trong nuôi cấy.
Dược động học
Hấp thu:
Lamivudine và zidovudine được hấp thu qua đường tiêu hóa. Ở người lớn, sinh khả dụng đường uống của lamivudine từ 80 – 85% và của zidovudine từ 60 – 70%.
Phân bố:
Tỷ lệ trung bình nồng độ lamivudine và zidovudine trong dịch não tủy (CSR)/huyết thanh tương ứng khoảng 0,12 và 0,5 sau khi uống 2 – 4 giờ.
Chuyển hóa:
Lamivudine ít bị chuyển hóa. Khả năng tương tác chuyển hóa của các thuốc với lamivudine thấp do mức độ chuyển hóa ở gan thấp (5 – 10%). Tỉ lệ gắn kết với huyết tương thấp.
5′-glucuronid là chất chuyển hóa chính của zidovudine trong huyết tương và nước tiểu, chiếm khoảng 50 – 80% liều dùng.
Thải trừ:
Lamivudine bị thải trừ chủ yếu qua thận dưới dạng không đổi. Thời gian bán thải của lamivudine là 5 – 7 giờ. Độ thanh thải toàn thân trung bình của lamivudine khoảng 0,32 lít/giờ/kg, chủ yếu ở thận (> 70%) thông qua hệ thống vận 1 chuyến cation hữu cơ. Các nghiên cứu ở bệnh nhân suy thận cho thấy sự thải trừ lamivudine bị ảnh hưởng bởi rối loạn chức năng thận.
Zidovudine thải trừ qua thận dưới dạng chất chuyển hóa 5′-glucuronid. Từ các nghiên cứu với zidovudine đường tiêm tĩnh mạch, thời gian bán thải cuối cùng trung bình trong huyết tương là 1,1 giờ và độ thanh thải toàn thân trung bình là 1,6 lít/giờ/kg.
Độ thanh thải thận của zidovudine ước tính 0,34 lít/giờ/kg cho thấy thuốc được lọc qua cầu thận và bài tiết chủ động qua ống thận. Nồng độ zidovudine tăng ở những bệnh nhân suy thận tiến triển.
Thành phần của Lamzidivir 300
Lamivudine………………………………..150mg
Zidovudine………………………………..300mg
Hướng dẫn sử dụng của Lamzidivir 300
Chỉ định:
Thuốc Lamzidivir 300 được chỉ định dùng điều trị nhiễm HIV.
Lamzidivir 300 được sử dụng trong liệu pháp kết hợp các thuốc kháng retrovirus để điều trị nhiễm HIV.
Chống chỉ định:
Thuốc Lamzidivir 300 chống chỉ định trong các trường hợp sau:
- Quá mẫn với bất cứ thành phần nào trong công thức.
- Bệnh nhân có số lượng bạch cầu đa nhân trung tính thấp bất thường (< 0,75 x 109/lít) hoặc nồng độ hemoglobin thấp bất thường (< 7,5 g/dl hoặc 4,65 mmol/lít).
Liều dùng & cách dùng:
Liều dùng:
Người lớn và thanh thiếu niên nặng ≥ 30 kg:
Liều khuyến cáo là 1 viên x 2 lần/ngày.
Trẻ em cân nặng > 21 kg đến 30 kg:
Liều khuyến cáo là 1/2 viên vào buổi sáng, 1 viên vào buổi tối.
Nếu không dung nạp qua đường tiêu hóa, có thể uống 1/2 viên x 3 lần/ngày để cải thiện dung nạp.
Trẻ em cân nặng 14 – 21 kg:
Liều khuyến cáo là 1/2 viên x 2 lần/ngày.
Điều chỉnh liều: Do ở dạng kết hợp với liều cố định, Lamzidivir không nên chỉ định cho những bệnh nhân cần điều chỉnh liều như những người suy giảm chức năng thận (độ thanh thải creatinin ≤ 50 ml/phút), bệnh nhân suy giảm chức năng gan, bệnh nhân có phản ứng không mong muốn về huyết học hoặc những bệnh nhân đang bị tác dụng không mong muốn do liều.
Cách dùng:
Dùng đường uống, có thể uống cùng hoặc không cùng với thức ăn. Để đảm bảo uống toàn liều, nên nuốt viên thuốc, không nghiền.
Đối với bệnh nhân không thể nuốt nguyên viên, nghiền nát viên, cho thêm vào một lượng nhỏ thức ăn lỏng hoặc chất lỏng, cần dùng ngay.
Bảo quản
Bảo quản nơi khô ráo thoáng mát.
Tránh ánh nắng trực tiếp.
Tác dụng không mong muốn
Đã có báo cáo về những tác dụng không mong muốn. Đọc kĩ hướng dẫn sử dụng để nhận biết được các dấu hiệu.
Tương tác thuốc
Lamzidivir có chứa lamivudine và zidovudine, do đó bất kỳ tương tác nào được xác định cho từng hoạt chất riêng lẻ đều có liên quan đến Lamzidivir. Các nghiên cứu lâm sàng cho thấy không có sự tương tác có ý nghĩa về lâm sàng giữa lamivudine và zidovudine.
Zidovudine được chuyển hóa chủ yếu bằng các enzym UGT; sử dụng đồng thời các thuốc cảm ứng hoặc ức chế enzym UGT có thể làm thay đổi nồng độ zidovudine. Lamivudine được thanh thải ở thận.
Sự bài tiết lamivudine chủ động ở thận qua nước tiểu nhờ trung gian các chất vận chuyển cation hữu cơ (OCTS); sử dụng đồng thời lamivudine với chất ức chế OCT hoặc các thuốc gây độc thân có thể làm tăng nồng độ lamivudine.
Lamivudine và zidovudine không được chuyển hóa đáng kể bởi các enzym cytochrom HP450 (như CYP 3A4, CYP 2C9 hoặc CYP 2D6) cũng không ức chế hoặc cảm ứng hệ thống enzym này. Do đó, có rất ít tiềm năng tương tác với các chất ức chế protease I kháng retrovirus, các chất không nucleosid và các thuốc khác được chuyển hóa chủ yếu bởi các enzym P450.










Reviews
There are no reviews yet.